imagem clicável
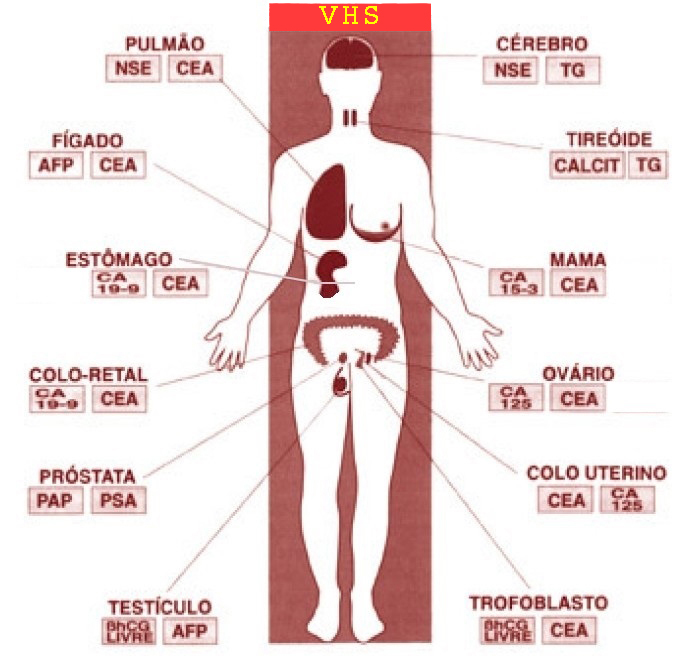
Aspectos Gerais dos Marcadores
|
|
imagem clicável  Aspectos Gerais dos Marcadores |
|
|
Marcadores Tumorais são substâncias que podem ser encontradas em quantidades acima do normal no sangue, urina ou tecidos do corpo de alguns pacientes com certos tipos de câncer. Um marcador tumoral pode ser produzido pelo próprio tumor ou pelo corpo, em resposta à presença do câncer.
Testes para marcadores tumorais podem ser realizados junto com outros testes ou raios-x para detectar e diagnosticar alguns tipos de câncer. Testes de marcadores tumorais não são usados sozinhos porque a maioria dos marcadores podem ser achados em níveis elevados em pacientes que têm condição não cancerosa e porque nenhum marcador tumoral é específico para um tipo particular de câncer. Também, nem todos pacientes de câncer têm um nível de marcador tumoral elevado; isto é especialmente verdadeiro nos primeiros estágios do câncer, quando níveis de marcadores tumorais estão freqüentemente na faixa normal. Embora o uso de marcadores tumorais para diagnosticar o câncer ainda esteja limitado, pesquisadores estão procurando por marcadores que sejam específicos para um determinado tipo de câncer e que possa ser usado para detectar a presença do câncer antes que os sintomas apareçam.
Médicos podem usar as mudanças nos níveis do marcador tumoral para seguir o curso da doença, para medir o efeito do tratamento e para verificar a reincidência. Em alguns casos, o nível do marcador tumoral reflete a extensão da doença (estágio) ou indica o quão rápido a doença parece progredir (prognóstico).
Os chamados marcadores tumorais (MT) são substâncias utilizadas como indicadores de malignidade. Na maioria dos casos, são produtos normais do metabolismo celular que apresentam aumento de produção devido à transformação maligna. Os MT têm auxiliado a clínica nas seguintes situações:
Os MT conhecidos até hoje não são sensíveis o suficiente para serem usados em triagem populacional ou para o estabelecimento de diagnóstico primário de câncer. Marcadores tumorais são substâncias biológicas produzidas pelo tumor ou liberadas pelo hospedeiro, que podem ser quantificadas através de exames de um líquido biológico tais como plasma, ascite, líquor, etc. O verdadeiro nível do marcador representa um equilíbrio entre sua produção e clareamento. Alguns tumores são produtores eficientes de marcadores, enquanto outros não o são. A sensibilidade de um teste será aqui definida como a porcentagem de pacientes com uma determinada doença que têm níveis elevados de marcadores, enquanto a especificidade será o percentual de pacientes sem doença que têm níveis normais do marcador. A maioria das técnicas diagnósticas não-invasivas utilizadas para detecção de câncer apresenta uma sensibilidade mínima de detecção da ordem de 108 - 109células e, usualmente, não informam sobre a viabilidade das células presentes na massa tumoral. Esta limitação tem estimulado a pesquisa de métodos mais específicos e sensíveis o suficiente para detecção de câncer em fase inicial, preferentemente com populações celulares inferiores a 106 células. O marcador tumoral ideal deveria ser específico para um determinado tipo de tumor e sensível o bastante para detectar volumes tumorais antes da disseminação neoplásica (ou seja, de utilidade para triagem e diagnóstico precoce); e ainda ser produzido apenas pelo tumor e secretado em quantidades mensuráveis nos fluidos corpóreos; além de ser detectado apenas na presença de câncer e seu nível deveria refletir o volume tumoral e/ou taxa de crescimento do tumor, resposta ao tratamento e progressão da doença. Talvez a aplicação mais útil do marcador seja o monitoramento da terapia, de tal forma que níveis crescentes indicassem pobres resposta e níveis decrescentes indicassem resposta favorável ao tratamento. As elevações séricas de um determinado marcador podem, mas usualmente não o fazem, diagnosticar malignidade, especialmente porque, com freqüência, condições não malignas podem também produzir elevações deste marcador. Em situações nas quais a incidência de câncer é elevada em determinadas populações, triagem com uso de marcador tumoral pode ser possível. Um exemplo é o uso de alfa-fetoproteína (AFP) para triagem do carcinoma hepatocelular na China, Alasca e Japão. Poucos marcadores são específicos para um único tumor (marcador-tumor-específico); a maioria é encontrada em diferentes tumores do mesmo tipo de tecido (marcador tumor-associado). Eles estão presentes em maiores quantidades em tecido canceroso ou no sangue de pacientes portadores de câncer comparativamente a tecidos de tumores benignos ou sangue de indivíduos normais. Poucos marcadores são específicos para o órgão onde o tumor se desenvolve. Uma das possíveis exceções era o antígeno prostático-específico (PSA), que se acreditava produzido exclusivamente pelo tecido prostático e que hoje sabe-se ser produzido, em pequenas quantidades, por outros tecidos como mama e ovário. Infelizmente, o marcador tumoral ideal ainda não existe, embora muitos marcadores úteis, mas imperfeitos, estejam disponíveis. Esta revisão dará ênfase ao uso clínico de alguns marcadores tumorais disponíveis comercialmente, assim como a alguns outros ainda em fase de investigação. Serão discutidos os aspectos biológicos de cada marcador, assim como seu papel no que diz respeito a triagem (se aplicável), diagnóstico e monitoramento de terapia, além de sua correlação com o estágio e prognóstico do tumor
Marcadores Tumorais
Publicado por Diagnósticos da América, site admirável!
O marcador tumoral perfeito seria aquele que fosse
produzido somente
por um tecido e secretado em quantidades mensuráveis em fluidos
corpóreos, só estaria positivo na presença de uma
neoplasia maligna e deveria ser capaz de identificá-la antes de
sua expansão além do seu local de origem. Seus níveis
séricos deveriam refletir o tamanho do tumor, permitir caracterizar
seu tipo e estadiamento e refletir respostas ao tratamento e à
progressão
da doença. Esse marcador tumoral perfeito ainda não existe.
Se existisse, poderia ser usado como triagem para a presença da
neoplasia oculta em indivíduos assintomáticos, permitindo
o diagnóstico e o tratamento precoce. Na prática, a maioria dos marcadores tumorais é achada em baixas concentrações em indivíduos normais e em quantidades mais altas durante processos inflamatórios e outras condições malignas e não-malignas. Por isso, seu papel mais importante não está no diagnóstico da neoplasia, e sim como um co-fator, orientador e confirmatório, do diagnóstico, com um papel definido na avaliação das recidivas, na resposta à terapia e na avaliação do prognóstico de evolução do tumor. Os marcadores tumorais são divididos em 5 categorias: - Enzimas e proteínas - Glicoproteínas - Glicoproteínas mucinas - Hormônios - Moléculas do sistema imune. Classificação dos marcadores tumorais Marcadores produzidos por câncer incluem enzimas e isoenzimas, hormônios, antígenos oncofetais, glicoproteínas, moléculas do sistema imunológico, produtos de oncogenes e transformações genéticas. As enzimas constituem um dos primeiros grupos de marcadores tumorais identificados. Suas atividades elevadas foram utilizadas para indicar a presença de câncer. Os hormônios têm sido usados para detecção e monitoramento do câncer, especialmente após a introdução de métodos específicos de rádio-imuno-ensaio para um hormônio em particular que tenha muito pouca reação cruzada com hormônio semelhante, como ocorre com a gonadotrofina coriônica humana, fração Beta (ß-hCG). Antígenos oncofetais, tais como AFP e CEA, foram descobertos utilizando-se anti-soros convencionais produzidos contra fluidos de animais portadores de câncer ou extratos de tecidos cancerosos. Após imunoabsorção com extratos de tecidos normais, os anti-soros resultantes foram testados para especificidade tumoral. O desenvolvimento das técnicas de anticorpo monoclonal permitiram medidas de antígenos tumorais mais sensíveis e específicas. Novos antígenos foram descobertos pelo desenvolvimento de anticorpos monoclonais contra preparados de células tumorais. Foi assim que antígenos como CA 125, CA 15-3 e CA 19-9 foram identificados. Muitos destes marcadores de superfície celular são glicoproteínas ou mucinas. Eles parecem ter melhor sensibilidade e especificidade que os antígenos oncofetais. Finalmente, os marcadores genéticos têm demonstrado enorme potencial diagnóstico, especialmente com o advento da técnica de reação em cadeia da polimerase (PCR). Dois tipos de marcadores - mutações de oncogenes e genes supressores e produtos dos oncogenes -se provaram clinicamente úteis, além de sua aplicação como marcadores tumorais. As áreas de aplicação incluem estabelecimento de fator de risco para desenvolvimento de câncer em cromossomas. Os marcadores genéticos podem elucidar a progressão normal para benigno, de benigno para doença primária e de doença primária para estágios metastáticos.
Marcadores enzimáticos
Com raras exceções, um aumento do nível de uma enzima ou isoenzima não é específico ou sensível o bastante para ser usado na identificação do tipo de câncer ou órgão específico comprometido. Uma exceção é o PSA, expresso em quantidades significativas apenas por tecido prostático normal, benigno, hiperplásico e canceroso. Até a aplicação do PSA como marcador para tumor de próstata, enzimas e isoenzimas tumorais haviam perdido grande parte de sua popularidade para uso como marcadores tumorais (aplicabilidade esta que antecedeu a descoberta dos antígenos ancofetais e o advento dos anticorpos monoclonais). As anormalidades de enzimas como marcador tumoral são a expressão da forma fetal da enzima (isoenzima) ou a produção ectópica de enzimas. As enzimas estão presentes em concentrações muito maiores no interior das células do que fora delas. Elas são liberadas na circulação sistêmica como resultado da necrose tumoral ou da mudança da permeabilidade da membrana das células tumorais . Os níveis das enzimas podem também estar elevados no bloqueio dos ductos biliares ou pancreáticos, assim como na vigência de insuficiência renal. À época da liberação das enzimas na circulação sistêmica, o processo de metastatização dos tumores já poderá ter ocorrido. A maioria das enzimas não é única para um órgão específico. Consequentemente, enzimas são mais adequadas como marcadores tumorais não específicos. Níveis elevados podem indicar a presença de malignidade. Isoenzimas e enzimas podem fornecer especificidade adicional para determinado órgão. Tradicionalmente, as enzimas são medidas através de suas atividades.
GlicoProteínas
As glicoproteínas constituem a maioria dos marcadores tumorais e podem derivar de tecidos placentários (ß-hCG) ou de vários tecidos fetais (CEA, AFP); podem também ser encontradas em pequenas quantidades em vários tecidos normais do homem adulto. Estes marcadores tumorais geralmente contêm menos de 20% de carboidratos, embora alguns, como o CEA, possam conter até 60%. Os determinantes antigênicos se encontram na cadeia polipeptídica. As glicoproteínas não são tumor-específicas.
Glicoproteínas
As glicoproteínas são marcadores tumorais derivados de tecido fetal ou placentário, encontrados em pequenas quantidades no tecido de adulto normal. Portanto, esses marcadores não são específicos para nenhum tumor. Exemplos de marcadores tumorais dessa classe são antígeno carcinoembrionário (CEA), alfafetoproteína (AFP), gonadotrofina coriônica humana, (HCG), antígeno polipeptídio tecidual (TPA), antígeno do carcinoma de células escamosas (SCC-A) e antígeno prostático específico (PSA).
Glicoproteínas Mucinas
Glicoproteínas mucinas são antígenos de superfície celular de alto peso molecular. Elas são compostos por 60 a 80% de carboidrato e têm uma semelhança estrutural com os antígenos de grupo sangüíneo Lewis A e B. As glicoproteínas mucinas expressas na superfície epitelial incluem CA 15-3, MCA, CA 19-9 e CA 125.
Hormônios
Os hormônios têm sido reconhecidos como marcadores tumorais por mais de meio século. Com o advento de imunoensaios e do uso de anticorpos monoclonais, a medida dos hormônios é agora acurada e precisa. A produção de hormônios no paciente oncológico envolve duas vias. Primeiro, pode haver uma produção excessiva de um hormônio pelo tecido endócrino que normalmente o produz. Segundo, o hormônio pode ser produzido em um sítio distante, por um tecido não endócrino que, não o produz (síndrome ectópica). A produção de hormônio adrenocorticotrópico (ACTH) pela hipófise e por carcinoma de pequenas células do pulmão exemplifica estas duas vias. Consequentemente, elevação do nível de um determinado hormônio não é base para diagnostico de um tumor específico. Apudoma é um grupo de tumores embriologicamente relacionados de órgãos endócrinos. Células APUD têm propriedades dos tecidos neural e endócrino, que sintetizam uma série de hormônios polipeptídicos como ACTH, calcitonina, gastrina, glucagon, insulina, secretina, hormônio estimulante do melanócito e polipeptídeos vasoativos intestinais ( VIP ). A freqüência de produção hormonal se correlaciona com o grau de relação embriológica da origem do câncer com outros tecidos do sistema APUD. Oncogenes e produtos de genes como marcadores tumorais
A próxima geração de marcadores tumorais descoberta deverá incluir a descoberta de mutações em oncogenes, quantificações de proteínas codificadas através desses oncogenes, ou talvez auto-anticorpos produzidos pelas oncoproteínas na translocação cromossomial, algumas das quais podem ser descobertas através de técnicas de citogenética e também através de estudos usando hibridização com sondas radioativas, inclusive bcr/abl na leucemia mielogênica crônica, bcl-2 em linfomas foliculares e myc em linfomas e outras leucemias
Genes supressores do tumor (TSGs) regulam o crescimento das células, parando sua proliferação. Mutações em TSGs conhecidas envolvidas com neoplasias incluem inativação do gene de Rb encontrado no retinoblastoma familiar, gene de APC em polipose familiar do cólon, WT-1 no tumor de Willms e p53 encontrado em uma grande variedade de tumores (epiteliais, leucemia, linfoma, sarcoma e neurogênicos). Um ensaio imunofluorimétrico para quantificação da proteína p53 tem demonstrado sua presença no câncer ovariano e no câncer de mama.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
||
|
|
|